- Simona Uggeri
- Articoli originali
Ematoma spinale epidurale spontaneo: una sfida diagnostica
- 2 - Maggio 2013
- ISSN 2532-1285
Abstract
Spontaneous Spinal Epidural Hematoma (SSEH) is a rare but serious condition, most often first seen in emergency departments. SSEH is an accumulation of blood in the epidural space that can compress the spinal cord, leading sometimes to disabling neurological sequelae. The typical symptom of SSEH is severe back or neck pain, followed by symptoms and signs of spinal cord compression. Detailed history, taking and accurate neurologic examination, are important tools for early diagnosis, and magnetic resonance imaging (MRI) is currently the diagnostic method of choice. Rapid decompressive surgery is very important in achieving positive clinical outcomes. Here we present a case of a 52-year-old caucasian man who developed severe neck pain and progressive weakness and numbness over left arm and leg. MRI demonstrated an epidural mass extending from C3 through T1, causing spinal cord compression. Emergent decompressive laminectomy was performed. Optimal functional outcomes were obtained.
Caso clinico
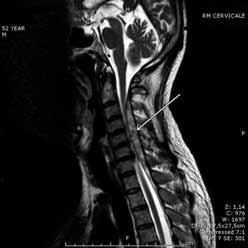
Paziente maschio caucasico, di anni 52, chiama il 118 per dolore cervico-dorsale molto intenso. La centrale operativa invia a domicilio un’automedica spoke, con equipaggio costituito da medico e infermiere. Il paziente riferisce un dolore cervico-dorsale mediano insorto da 3 ore, molto intenso e ingravescente. Paziente con dislipidemia e ipertensione arteriosa, in trattamento con statina e sartano; non assume terapia anticoagulante, né antiaggregante. Familiarità per patologie cardiovascolari: cardiopatia ischemica e aortica, con decessi nella quinta e sesta decade. Non fuma, ha sempre goduto di buone condizioni di salute, a parte occasionali episodi di cervicalgia e artralgie. All’esame clinico il paziente è sofferente, ma vigile e collaborante. Orientato nel tempo e nello spazio. Presenta una posizione obbligata degli arti superiori, che si presentano estesi: il tentativo di riportare gli arti superiori a fianco del tronco provoca un peggioramento della sintomatologia dolorosa cervico-dorsale. Riferisce parestesie e iniziale perdita di forza agli arti superiore e inferiore di sinistra. Non sono presenti altri sintomi neurologici. I polsi arteriosi centrali e periferici sono normosfigmici. Pressione arteriosa 140/90 mm/Hg, frequenza cardiaca 60 bpm, saturazione d’ossigeno al pulsiossimetro 100%. Obbiettività cardiovascolare nella norma. Nel sospetto di una patologia importante, viene trasportato in ambulanza, con accompagnamento di medico e infermiere al Pronto Soccorso Hub. In Pronto Soccorso, per dolore cervico-dorsale molto intenso e parestesie agli arti inferiori di sinistra, viene attribuito al caso un codice giallo. Alla visita del medico di guardia si riscontra dolore cervico-dorsale mediano, deficit di forza agli arti superiore e inferiore di sinistra. Conferma l’anamnesi familiare e farmacologica riferita in precedenza sul territorio. Riferisce inoltre che il giorno precedente ha sollevato un peso. I parametri vitali sono nei limiti: saturazione d’ossigeno al pulsiossimetro 98%, pressione arteriosa 145/90 mmHg, identica ai due arti superiori. Apiretico. L’obbiettività cardiaca e toracica è negativa. Polsi periferici normosfigmici. É orientato nel tempo e nello spazio. Non presenta segni di meningismo. Gli esami di laboratorio, comprensivi di emocromo, coagulazione, glicemia, funzione epatica e funzione renale sono nella norma. La sintomatologia non recede dopo terapia con ketoprofene. Alla rivalutazione clinica il paziente riferisce impaccio alla deambulazione, per ipostenia all’arto inferiore sinistro. Il paziente viene quindi sottoposto a visita specialistica neurologica. Lo specialista rileva: non deficit dei nervi cranici, in Barrè pronazione a sinistra, deficit di forza 4/5 all’arto superiore sinistro, marcia falciante all’arto inferiore sinistro, nulla da segnalare a destra. Si sospetta dunque una mielopatia cervicale, il neurologo pone indicazione a risonanza magnetica cervicale urgente, che rivela ematoma epidurale acuto posteriore e posterolaterale a sinistra, con estensione da C3 a D1, che impronta il midollo soprattutto nel tratto C4-C6
(fig. 1). Il paziente viene quindi prontamente ricoverato in ambito neurochirurgico e sottoposto a intervento di decompressione e rimozione dell’ematoma. Il trattamento chirurgico è stato intrapreso entro 12 ore dall’inizio della sintomatologia. Il giorno successivo viene eseguito l’esame di risonanza magnetica post-operatorio, che rileva una corretta decompressione. Dopo l’intervento, il paziente ha avuto un ottimo recupero funzionale. Nel follow-up a 3 mesi, il paziente ha recuperato completamente la funzione motoria: si rileva anche che ha ripreso l’attività lavorativa e svolge attività sportiva.
L’evidenza
L’ematoma spinale epidurale spontaneo è una raccolta di sangue nello spazio epidurale vertebrale, in grado di causare una compressione del midollo spinale, non dovuta a traumi o a manovre iatrogene. In letteratura viene riportata una incidenza di 0.1 caso per 100.000 abitanti (1). Le sedi più frequenti, secondo una distribuzione bimodale, sono C6 e T12 (2). Anche l’età di incidenza ha una distribuzione bimodale, con un picco a 15-20 anni e un picco a 65-70 anni (1). Viene riportata una maggior incidenza nella popolazione asiatica (1). Il rapporto maschio/femmina è 1,5:1 (5). L’eziologia dell’ematoma spinale epidurale spontaneo è riconducibile a malformazioni vascolari (1), coagulopatie (2), assunzione di farmaci anticoagulanti (2) o antiaggreganti (2, 3). Sono stati riportati alcuni casi aneddotici avvenuti dopo manovre di manipolazione chiropratica (1). In letteratura sono attestati numerosi casi (1,2,3,4,5,6,9) in cui la sintomatologia insorge dopo aver effettuato esercizio fisico.
Dal punto di vista fisiopatologico, sono descritti tre meccanismi che portano a sviluppare un ematoma spinale epidurale: rottura di vene epidurali, rottura di arterie epidurali ed emorragie da anomalie vascolari (3). Alcuni studi sostengono che l’ematoma sia causato da rottura di vene epidurali e postulano un locus di minor resistenza che cede per la trasmissione di pressione intratoracica o intraddominale. Questo può succedere in seguito a minimi sforzi durante la tosse o la defecazione o durante il sollevamento di un grave. L’ipotesi del sanguinamento venoso è supportata dal fatto che il plesso venoso epidurale è diviso in una porzione posteriore più larga e in una porzione anteriore più stretta coperta dal legamento vertebrale longitudinale posteriore: questo corrisponde all’osservazione che la maggior parte degli ematomi sono localizzati nella parte posteriore dello spazio epidurale. Da studi autoptici risulta che il plesso venoso posteriore vertebrale presenta la forma di “ponti” trasversali prominenti da C5 a T2: questo costituirebbe un locus di minor resistenza, in cui è possibile il verificarsi di un sanguinamento (1, 2). Secondo altri autori la sintomatologia radicolare suggerisce un sanguinamento a livello delle arterie radicolari, che corrono lungo le radici dei nervi ed entrano nel canale spinale, formando arterie longitudinali a ponte che possono facilmente essere lese in corso di stimoli meccanici. Questa ipotesi viene supportata da evidenze operatorie, nelle quali si è osservato come l’ematoma sia spesso in corrispondenza della radice dei nervi radicolari (1). In alcuni casi l’ematoma epidurale si forma per rottura di piccole anomalie vascolari epidurali, che rappresentano un locus di minor resistenza. Probabilmente le anomalie vascolari talora non vengono riconosciute, poiché coperte dall’ematoma o distrutte (1). Attualmente non vi è una spiegazione univoca sulla fisiopatologia dell’ematoma spinale epidurale spontaneo.
La presentazione clinica è caratterizzata da esordio con dolore al collo e/o al dorso improvviso e severo, che non recede con la terapia analgesica. Successivamente il dolore si accompagna a segni e sintomi di compressione midollare o di compressione radicolare (1). Il deficit motorio e/o sensitivo, è ingravescente nel giro di poche ore.
La progressiva compressione midollare, se non trattata, può portare a deficit neurologici permanenti. La sintomatologia neurologica comprende paraparesi, disfunzione sfinteriale e tetraplegia. In alcuni casi la sintomatologia dolorosa può essere assente (1). In alcuni casi l’esito è fatale, per l’estensione ai livelli cervicali sopra a C5, per il coinvolgimento dei centri del respiro e la conseguente depressione respiratoria (1, 2). La diagnosi differenziale si pone con le seguenti patologie: emorragia spinale subaracnoidea, rottura acuta di disco intervertebrale, neoplasia epidurale, mielite trasversa, aneurisma disseccante dell’aorta, spondilite, sindrome di Guillain-Barrè, mielomalacia, frattura vertebrale patologica (3). Viene riportato, purtroppo, che la sintomatologia tipica compare solo nell’88% dei casi (3). Nei rimanenti si hanno manifestazioni cliniche anomale (1): sono attestati casi di dolore toracico, dolore addominale, cefalea e anche casi di esordio senza dolore. In questi casi la diagnosi viene posta alla comparsa dei sintomi di compressione radicolare, talora dopo ore o giorni dall’insorgenza della sintomatologia. Il sospetto diagnostico è posto dal clinico, spesso in Pronto Soccorso. La Risonanza Magnetica Nucleare (RMN) spinale cervicale dorsale è la metodica diagnostica scelta: essa evidenzia l’estensione e la posizione dell’ematoma, la compressione del midollo, la presenza di edema e la presenza di malformazioni vascolari (1). Il trattamento è chirurgico ed è finalizzato alla rimozione dell’ematoma. La tecnica operatoria più usata è la laminectomia. Un’altra tecnica chirurgica descritta è l’emilaminectomia, decompressione interlaminare. La scelta del tipo di intervento è una prerogativa dello specialista neurochirurgo, che valuta come ridurre al minimo il danno midollare. Non vi sono evidenze che supportano l’utilizzo di corticosteroidi, come terapia addizionale (25). I fattori prognostici più importanti sono rappresentati dal tempo che intercorre tra l’insorgenza della sintomatologia e l’intervento chirurgico e dalla severità dei deficit neurologici presenti prima dell’intervento (1,2,3,24,26). Kreppel (3) ha condotto un’interessante meta-analisi, in cui ha esaminato una casistica di 605 ematomi spinali, di cui 455 epidurali. Ha rilevato la completa ripresa funzionale nel 39.6% dei casi, deficit neurologici permanenti nel 34.4%, nessun miglioramento funzionale nel 14.4%, decesso a causa dell’ematoma nel 5.5%, decesso per altre cause nel 6.1% dei casi. È molto interessante in questo studio l’osservazione dell’outcome in relazione alla tempestività del trattamento chirurgico: i pazienti che hanno ricevuto il trattamento chirurgico entro 12 ore dall’inizio dei sintomi, hanno avuto una completa ripresa funzionale nel 65.9% dei casi, hanno avuto un deficit neurologico lieve nel 12.8% dei casi, invece nel 12.8% dei casi l’esito è stato sfavorevole (deficit neurologico grave permanente o nessun miglioramento sintomatologico o decesso); i pazienti che sono stati trattati entro 13-24 ore dall’inizio dei sintomi hanno presentato nel 36% dei casi completo recupero funzionale o lieve danno neurologico e nel 64% grave danno neurologico o morte. Anche lo stato neurologico pre-operatorio è un fattore predittivo di outcome: i pazienti con paralisi dei quattro arti o completo deficit sensitivo hanno esitato nella maggior parte dei casi in severi deficit neurologici permanenti, o nel decesso; i pazienti con incompleta paralisi hanno avuto in percentuale un miglior esito.
La pratica
L’ematoma spinale epidurale spontaneo è una raccolta di sangue nello spazio epidurale vertebrale in grado di causare una compressione del midollo spinale, non dovuta a traumi o a manovre iatrogene. È una patologia rara, talora associata a malformazioni vascolari, a farmaci antiaggreganti, a coagulopatie o ad assunzione di farmaci anticoagulanti, a manipolazione chiropratica oppure a sforzo fisico. All’esordio si presenta con forte dolore al collo e/o al dorso e segni di ingravescente compressione midollare o radicolare. La progressiva compressione midollare può portare a deficit neurologici permanenti. La sintomatologia neurologica comprende paraparesi, disfunzione sfinteriale e tetraplegia. In alcuni casi l’esito può anche essere fatale, per estensione ai livelli cervicali alti, con interessamento dei centri del respiro. La diagnosi è in prima istanza clinica e richiede una conferma diagnostica con RMN spinale cervico-dorsale. Fattori prognostici: tempo che intercorre tra l’insorgenza della sintomatologia e l’intervento chirurgico; inoltre severità dei deficit neurologici presenti prima dell’intervento. Trattamento di scelta: decompressione chirurgica dell’ematoma. Per un buon esito è dunque necessario un corretto e rapido inquadramento clinico, una precoce diagnosi strumentale ed un rapido intervento neurochirurgico. I medici dell’emergenza devono conoscere questa patologia, anche se rara, in quanto tempo-dipendente, invalidante e in alcuni casi mortale. Anche nell’ambito dell’emergenza-urgenza sul territorio, l’anamnesi approfondita e l’esame obbiettivo sono sempre un importante strumento per impostare un percorso diagnostico. Qualora vi sia fondato sospetto di questa patologia, si deve eseguire una centralizzazione primaria verso un centro HUB dotato di RMN, un reparto di terapia intensiva o un reparto di neurochirurgia. In Pronto Soccorso l’unico esame che ha consentito la diagnosi è stata la RMN, un esame generalmente non indicato d’urgenza. Una precoce valutazione neurochirurgica e un corretto timing dell’atto chirurgico sono indispensabili per il miglior esito della patologia. Si tratta quindi di una sfida diagnostica per il medico d’emergenza e di una sfida organizzativa per la struttura nosocomiale, in quanto una corretta gestione comprende l’intervento di vari attori di discipline diverse.
Bibliografia
Holtas S, Heiling M, Lonntoft M. Spontaneous spinal epidural hematoma: findings at MR imaging and clinical correlation. Radiology. 1996; 199: 409-413.
Groen R. Non operative treatment of spontaneous epidural hematomas: a review of the literature and a comparison with operative cases. Acta Neurochir. 2004; 146 (2): 103-110.
Kreppel D, Antoniadis G, Seeling W. Spinal hematoma: a literature survey with meta-analysis of 613 patients. Neurosurg Rev, 2003; 26: 1-49.
Kitamura Y, Onozuka S, Ichimura S, et al. Spontaneous epidural hematoma after coil embolization of cerebral aneurism: implication of high SSEH frequency in East Asia. Clin neurol and neurosurg. 2012; 3: 1-2.
Foo D, Rossier AB. Preoperative neurological status in predicting surgical outcome of spinal epidural hematomas. Surg Neurol. 1981; 15: 389-401.
Bisson EF, Dumont T, Tranmer B. Spontaneous epidural hematoma in a child with hemophilia B. Can J Neurol Sci. 2007; 34: 488-490.
Kirazli Y, Akkoc Y, Kanyilmaz S. Spinal epidural hematoma associated with oral anticoagulation therapy. Am J Phys Med Rehabil. 2004; 83: 220-223.
Clarke DB, Bertrand G, Tampieri D. Spontaneous spinal epidural hematoma causing paraplegia: resolution and recovery without surgical decompression. Neurosurgery. 1992; 30: 108-111.
Morales Ciancio RA, Drain O, Rillardon L, et al. Acute spontaneous spinal epidural hematoma: an important differential diagnosis in patients under clopidogrel therapy. Spine J. 2008; 8: 544-547.
Heiner JD. Cervical epidural hematoma after chiropratic spinal manipulation. Am J Emerg Med. 2009; 27 (8): 1023(1)- 1023(2).
Silber SH. Complete nonsurgical resolution of a spontaneous spinal epidural hematoma. Am J Emerg Med. 1996; 14: 391-393.
Hetschel SJ, Woolfenden AR, Fairholm DJ. Resolution of spontaneous spinal epidural hematoma without surgery. Spine. 2001; 26 (22): E525-E527.
Thiele RH, Hage ZA, Surdell DL, et al. Spontaneous spinal epidural hematoma of unknow etiology: case report and literature review. Neurocrit Care. 2008; 9: 252-246.
Chen CL, Lu CH, Chen NF. Spontaneous spinal epidural hematoma presenting with quadriplegia after sit-ups exercise. Am J Emerg Med. 2009; 27: 1170e3-1170.e7.
Abe T, Nagamine Y, Ishimatsu S. Spinal epidural hematoma after strech exercise: a case report. Hussenbocus SM, Wilby MJ, Cain C, et al. Spontaneous spinal epidural hematoma: a case report and literature review. J emerg Med. 2012; 42 (2): e31-e34.
Groen RJ, Groenewegen HJ, van Alphen HA, et al. Morphology of the human internal vertebral venous plexus: a cadaver study after intravenous araldite CY 221 injection. Anat Rec. 1997; 249: 285-294.
Groen RJ, Grobbelaar M, Muller CJ, et al. Morphology of the human internal vertebral venous plexus: a cadaver study after latex injection in the 21-25-week fetus. Clin Anat. 2005; 18: 397-403.
Beatty RM, Winston KR. Spontaneous cervical epidural hematoma. A consideration of etiology. J Neusurg. 1984; 61: 143-148.
Harik SI, Raichle ME, Reis DJ. Spontaneously remitting spinal epidural hematoma in a patient on anticoagulants. N Engl J Med. 1971; 284: 1355-1357.
Alexiadou-Rudolf C, Emestus RI, Nanassis K. Acute non-traumatic spinal epidural hematoma. An important differential diagnosis in spinal epidural emergencies. Spine. 1998; 23: 1810-1813.
Senelick RC, Norwood CW, Cohen GH. Painless spinal epidural hematoma during anticoagulant therapy. Neurology. 1976; 26: 213-215.
Liao CC, Lee ST, HSU WC, et al. Experience in the surgical management of spontaneous spinal epidural hematoma. J Neurosurg. 2004; 100 (1 suppl): 38-45.
Groen JR, van Alphen HA. Operative treatment of spontaneous spinal epidural hematomas: a study of the factors determinino postoperative outcome. Neurosurgery. 1997; 39: 494-508.
Messerer M, Dubourg J, Diabira S et al. Spinal epidural hematoma: not always an obvious diagnosis. Eur J Em Med. 2012; 19: 2-8.
Jamjoom ZA. Acute spontaneous spinal epidural hematoma: the influence of magnetic resonance imaging on diagnosis and treatment. Surg. Neurol. 1996; 46: 345-349.
Lawton MT, Porter RW, Heiserman JE, et al. Surgical management of spinal epidural hematoma: relationship between surgical timing and neurological outcome. J Neurosurg. 1995; 83: 1-7.
Shin JJ, Kuh SU, CHO YE et al. Surgical management of spontenous spinal epidural hematoma. Eur Spine J. 2006; 15:998-1004.
Fukui MB, Swarnkar AS, Williams RL. Acute spontaneous spinal epidural hematoma. Am J Neuroradiol. 1999; 20: 1365-1372.

